聚焦創新與質量 解讀國家藥監局2019年度藥品審評報告
國家藥品監督管理局(NMPA)正式發布了《2019年度藥品審評報告》,這份報告不僅是對過去一年藥品審評審批工作的全面總結,更是觀察中國醫藥產業發展趨勢與技術開發前沿的重要窗口。報告顯示,2019年我國藥品審評審批效率持續提升,創新藥與仿制藥的研發與上市步伐顯著加快,技術開發正成為驅動行業高質量發展的核心引擎。
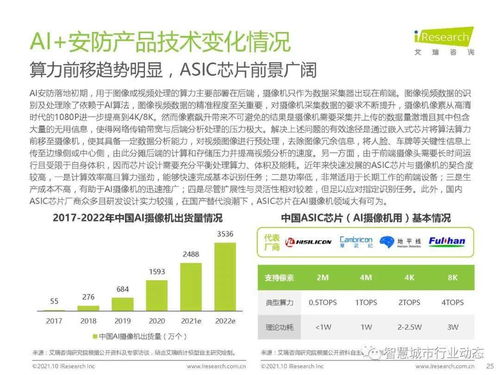
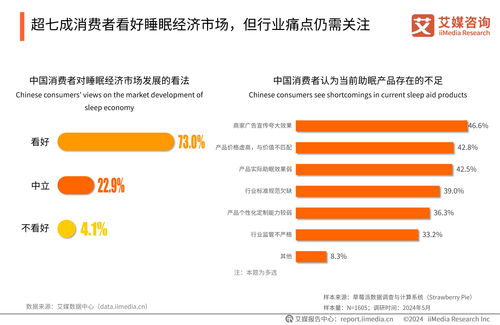
報告指出,2019年藥品審評中心(CDE)完成審評審批的注冊申請數量較往年有顯著增長,其中納入優先審評程序的藥品數量大幅增加,這體現了國家對于臨床急需、具有明顯臨床價值的藥品研發給予的強力支持。特別是在抗腫瘤、抗病毒、罕見病治療等領域,創新藥的審評通過率與速度均呈現積極態勢,一批具有自主知識產權的原創新藥成功獲批上市,標志著我國醫藥創新能力的實質性突破。
技術開發層面,報告著重強調了藥品研發中新技術、新方法的應用與審評體系的適應性升級。2019年,基因治療、細胞治療等前沿生物技術產品的審評路徑進一步明晰,相關技術指導原則陸續出臺,為這類高風險、高技術產品的規范研發與審評提供了科學依據。仿制藥質量與療效一致性評價工作深入推進,通過嚴格的技術審評,確保仿制藥與原研藥在質量和療效上達到一致,有力促進了藥品可及性與行業整體技術水平的提升。
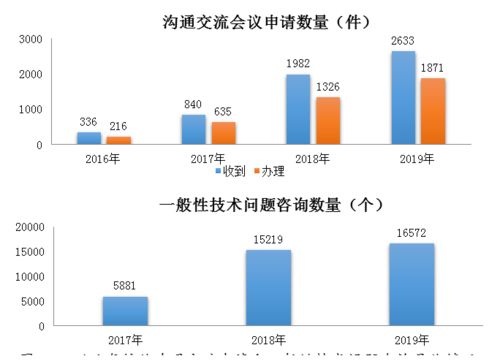
報告也反映出審評體系自身的技術能力建設在不斷加強。通過優化審評流程、加強審評人員專業培訓、推進審評信息化建設等措施,藥品審評的科學性、規范性與透明度得到進一步提升。這為國內外制藥企業的技術開發活動創造了更加穩定、可預期的政策環境,鼓勵了更多資源投向高質量的創新研發。
綜觀報告,2019年度藥品審評工作取得的成果,是我國深化藥品審評審批制度改革、持續鼓勵藥物創新的直接體現。隨著《藥品管理法》的深入實施以及藥品監管科學行動的持續推進,技術開發與審評體系的互動將更加緊密。企業需緊跟技術發展趨勢,加強以臨床價值為導向的研發創新;而監管機構也將繼續完善基于風險的審評框架,護航安全、有效、高質量的藥品惠及廣大患者,共同推動我國從制藥大國向制藥強國邁進。
如若轉載,請注明出處:http://www.084y.cn/product/1.html
更新時間:2026-01-11 02:14:57